Bases, Ácidos y Sales
Introducción
En este blog aprenderemos sobre las bases, ácidos y sales. ademas de mencionar para que se utilizan para que sirven y demás temas que pueden ser útiles para entender mas sobre estos temas
Contenido
- Bases
- Propiedades de las bases
- Formación de una base
- Ejemplos de bases
- Ácidos
- Propiedades de los ácidos
- Aplicaciones de los ácidos
- Sales
- Nomenclatura
- Propiedades físicas y químicas
- Clasificación
- Importancia biológica
- Pantallasos aplicación yenga
- Conclusiones
- Webgrafia
Bases
Una base o alcali es cualquier sustancia que presente propiedades alcalinas. En primera aproximación (según Arrhenius) es cualquiersustancia que en disolución acuosa aporta iones OH− al medio. Un ejemplo claro es el hidróxido potásico, de fórmula
KOH: KOH → OH− + K+ (en disolución acuosa)
Propiedades de las Bases
Finalmente, según Boyle, bases son aquellas sustancias que presentan las siguientes propiedades:
- Poseen un sabor amargo característico.
- Sus disoluciones conducen la corriente eléctrica.
- Cambian el papel tornasol rojo en azul.
- La mayoría son irritantes para la piel (cáusticos) ya que disuelven la grasa cutánea. Son destructivos en distintos grados para los tejidos humanos. Los polvos, nieblas y vapores provocan irritación respiratoria, de piel, ojos, y lesiones del tabique de la nariz.
- Tienen un tacto jabonoso.
- Son solubles en agua (sobre todo los hidróxidos).
- Reaccionan con ácidos formando sal y agua.
Formación de las Bases
Una base se forma cuando un óxido metálico reacciona con agua (hidrólisis):
igual es:
Ejemplos de Bases
Algunos ejemplos de bases son:
- Soda cáustica (NaOH)
- Leche de magnesia (Mg(OH)2)
- Amoníaco (NH3)
- Jabón y detergente
Ácidos
Un ácido es considerado tradicionalmente como cualquier compuesto químico que, cuando se disuelve en agua, produce una solución con una actividad de catión hidronio mayor que el agua pura, esto es, un pH menor que 7.
Algunos ejemplos comunes son el ácido acético (en el vinagre), el ácido clorhídrico (en el Salfumant y los jugos gástricos), el ácido acetilsalicílico (en la aspirina), o el ácido sulfúrico (usado enbaterías de automóvil). Los ácidos pueden existir en forma de sólidos, líquidos o gases, dependiendo de la temperatura y también pueden existir como sustancias puras o en solución.
Propiedades de los Ácidos
- Tienen sabor agrio como en el caso del ácido cítrico en la naranja y el limón.
- Cambian el color del papel tornasol azul a rosa, el anaranjado de metilo de anaranjado a rojo y deja incolora a la fenolftaleína.
- Son corrosivos.
- Producen quemaduras de la piel.
- Son buenos conductores de electricidad en disoluciones acuosas.
- Reaccionan con metales activos formando una sal e hidrógeno.
- Reaccionan con bases para formar una sal más agua.
- Reaccionan con óxidos metálicos para formar una sal más agua.
Aplicaciones de los acidos
Hay numerosos usos de los ácidos. Los ácidos son usados frecuentemente para eliminar herrumbre y otra corrosión de los metales en un proceso conocido como pickling. Pueden ser usados también como electrolitos en una batería, como el ácido sulfúrico en una batería de automóvil.
Los ácidos fuertes, el ácido sulfúrico en particular, son ampliamente usados en procesamiento de minerales. Por ejemplo, los minerales de fosfato reaccionan con ácido sulfúrico produciendo ácido fosfórico para la producción de fertilizantes, y el cinc es producido disolviendo óxido de cinc en ácido sulfúrico, purificando la solución y aplicando electrólisis.
En la industria química, los ácidos reaccionan en las reacciones de neutralización para producir sales. Por ejemplo, el ácido nítrico reacciona con el amoníaco para producir nitrato de amonio, un fertilizante. Adicionalmente, los ácidos carboxílicos pueden ser esterificados con alcoholes en presencia de ácido sulfúrico, para producir ésteres.
Sales
Una sal es un compuesto químico formado por cationes (iones con carga positiva) enlazados a aniones (iones con carga negativa) mediante un enlace iónico. Son el producto típico de una reacción química entre una base y un ácido, donde la base proporciona el catión y el ácido el anión.
La combinación química entre un ácido y un hidróxido (base) o un óxido y un hidronio (ácido) origina una sal más agua, lo que se denomina neutralización.
Nomenclatura
Según la nomenclatura tradicional, las sales se denominan con el nombre del anión, con cierto prefijo y sufijo, seguido de la preposición de y el nombre del catión. Hay que distinguir entre distintos casos:
- En las sales de hidrácidos, se sustituye la terminación -hídrico del hidrácido del que proviene el anión para la terminación -uro.
- En las sales de oxoácidos, se sustituye la terminación -oso o-ico del oxoácido del cual proviene el anión por la correspondiente - ito o -ato.
- Las sales ácidas (sales que provienen de ácidos polipróticos y que contienen átomos de hidrógeno sustituibles) se denominan indicando el número de hidrógenos no sustituidos que quedan en la molécula, usando el prefijo correspondiente.
- Las sales básicas (sales que contienen iones hidroxilo, OH-) se nombran indicando el número de hidroxilos seguido del anión central y finalmente el catión.
Propiedades Físicas y Químicas
- Químicas

Las propiedades químicas vienen determinados por las propiedades de los cationes y aniones o una parte de ellos. Las sales reaccionan con los ácidos y las bases, obteniéndose el producto de reacción y un gas precipitado o una sustancia tal como agua

Las sales reaccionan entre sí y el producto resultante de la reacción (producen gas, y precipitan sedimentos o agua); estas reacciones pueden tener lugar con el cambio en los estados de oxidación de los átomos reactivos:

Algunas sales se descomponen cuando se calientan:
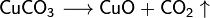
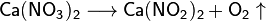
- Fisicas
En general, las sales son materiales cristalinos con estructura iónica. Esta estructura se refleja apropiadamente en sus propiedades físicas: tienen altos puntos de fusión y en estado sólido son dieléctricos.
De particular interés son los líquidos iónicos, con puntos de fusión por debajo de 100 °C. Durante la fusión anormal de líquidos iónicos prácticamente no hay presión de vapor, pero si una alta viscosidad. Las propiedades especiales de estas sales se explican por la baja simetría del catión, la interacción débil entre los iones y una buena distribución de la carga del catión.
- Color
Las sales pueden tener la apariencia de ser claras y transparentes (como el cloruro de sodio), opacas e incluso metálicas y brillantes
Las sales pueden tener muchos colores diferentes. Algunos ejemplos son:
- Amarillo (cromato de sodio)
- Naranja (cromato de potasio)
- Rojo (ferricianuro de potasio)
- Malva (cloruro de cobalto (II))
- Azul (sulfato de cobre (II), azul de Prusia)
- Lila (permanganato de potasio)
- Verde (cloruro de níquel (II))
- Blanco (cloruro de sodio)
- Negro (óxido de manganeso (IV))
- Sin color (sulfato de magnesio)
- Gusto
Las diferentes sales pueden provocar todos los cinco diferentes sabores básicos como, por ejemplo, el salado (cloruro de sodio), el dulce (acetato de plomo (II), que provoca saturnismo si se ingiere), el agrio (bitartrato de potasio), el amargo (sulfato de magnesio) y el umami (glutamato monosódico).
- Olor
Las sales de ácidos fuertes y bases fuertes (sales fuertes), no suele ser volátiles y no tienen olor, mientras que las sales tanto de bases débiles como de ácidos débiles (sal débil), pueden tener olor en forma de ácido conjugado
Clasificación
Las sales se pueden clasificar en los siguientes grupos:
- Sal haloidea, hidrácida o binaria neutra: son compuestos binarios formados por un metal y un no-metal, sin ningún otro elemento. El anión siempre va a tener la terminación-uro. Ejemplos: cloruro de sodio, NaCl; cloruro de hierro (III), FeCl3; sulfuro de hierro (II), FeS.
- Sal de oxácido: procede de sustituir los hidrógenos de un oxácido por cationes metálicos.
- Sal oxácida, oxiácida o ternaria neutra: se sustituyen todos los hidrógenos. Ejemplo: hipoclorito de sodio, NaClO.
- Sal ácida: se sustituyen parte de los hidrógenos. Ejemplo: hidrogenocarbonato de sodio o bicarbonato de sodio, NaHCO3.
- Sal básica o hidroxisal: contienen iones hidróxido (OH-), además de otros aniones. Se pueden clasificar como sales o hidróxidos. Ejemplo: hidroxicarbonato de hierro (III), Fe(OH)CO3.
Importancia Biológica
Las sales químicas pueden tener varias funciones:
- Función estructural: las sales sólidas forman la estructura de los minerales y las estructuras esqueléticas (externas o internas) de protección y de sostenimiento de los organismos.
- Función reguladora:
- Función del tampón del pH: las sales son sustancias que regulan el pH de una disolución.
- Presión osmótica: la ósmosis es un fenómeno que se produce cuando hay dos disoluciones diferentes de concentraciones diferentes separadas por una membrana semipermeable que permite el paso de las sustancias de bajo peso molecular. Tiene la función de igualar las dos disoluciones de manera que tengan la misma concentración mediante el paso del disolvente.
- Funciones específicas: muchas sales o sus iones son necesarios para determinados procesos biológicos como la contracción muscular, la transmisión de impulsos nerviosos, etc.
Quimica de Estefania Arboleda Rivera
Conclusiones
Conclusiones
Con las características vistas hemos analizado un poco más la naturaleza de los compuestos químicos vistos. Además, como se dijo anteriormente, se han podido crear relaciones entre el tipo de compuesto que es y los elementos involucrados, por ejemplo,tenemos que las bases tienen buena conductividad en soluciones acuosas, esto es debido a que además de estar conformado por no metales tenemos que se realiza un enlace iónico
Gracias al programa Yenka se pudo realizar el laboratorio y aprender sin necesidad de causarnos daños al provocar las reacciones,

No hay comentarios:
Publicar un comentario